Dětská neuroložka Jana Haberlová je přímou svědkyní a aktivním účastníkem toho, co sama nazývá „velkým kouzlem medicíny“. Ještě nedávno musela přihlížet, jak její malí pacienti chřadnou a odcházejí na zákeřnou nemoc zvanou spinální muskulární, tedy svalová atrofie (SMA). Jde o genetickou poruchu, kdy si tělo nedokáže vyrobit bílkovinu důležitou pro přenos informace o pohybu z nervů na svaly. Ty proto postupně ochabují, až pacient skončí zcela ochrnutý a nakonec ztratí i schopnost sám dýchat.
Před pěti lety vyhlídky českých pacientů změnil první léky na SMA. Později, před necelými dvěma roky, ale dorazila velká revoluce – první systémová genová léčba s názvem Zolgensma. „V případě záchytu nemoci ještě před rozvojem obtíží jednorázovou infuzí vyřešíte genetickou poruchu, pacient odejde a už vás teoreticky v budoucnu nebude potřebovat,“ říká Jana Haberlová, která tuto léčbu spolu s kolegy podává ve Fakultní nemocnici Motol.
S lékařkou jsme si povídaly nejen o začátcích této léčby, ale také o jejích možných rizicích, kdy ve zcela výjimečných případech může pacient po podání léčby zemřít na následky nežádoucích účinků.
V rozhovoru pro nadaci Dobrý anděl jste před pěti lety řekla, že „obor neurologie a zejména dětská neurologie je jedním z nejvíce se vyvíjejících oborů medicíny“. Stále to platí?
Myslím, že to platí. Nemůžu samozřejmě říci, že je to nejvíce se rozvíjející obor medicíny jako takové, protože jsem dětský neurolog a vnímám medicínu ze svého subjektivního pohledu, ale určitě je dětská neurologie obor, který se dneska významných způsobem mění a jednou z těch příčin, proč se mění, jsou nové možnosti léčby včetně léčby genové.
V tomto máte výjimečné postavení. Před necelými dvěma lety jste mohli prvnímu českému pacientovi podat léčivo na principu genové terapie. Ta je přitom obecně v léčbě naprostou novinkou a v ČR stále spíše unikátem.
Lék, který používáme, je první lék na systémovou genovou léčbu v medicíně. Takže je to pro nás opravdu převratná věc. Je to první systémová genová léčba vůbec. Nikdy předtím ani potom se nic na tomto principu pacientům nepodávalo.
Léčit tam, kde to dříve nešlo, pro vás asi musí být velká radost, že?
Vidět a ukazovat videa, na kterých je zaznamenán pacientův pokrok po léčbě, je pro dětské neurology opravdu radost. Takže je to velmi hezké období. Zároveň je ale také velmi náročné, protože použití takto unikátní nové léčby nás staví do zcela nové role. Jsme v situaci, kdy máme nějaké informace, ale ty se mohou za rok či za dva změnit, takže je zde určitá nejistota v tom, zda všechno to, co a jak děláme, děláme správně. Tak to, bohužel, je a my to takto říkáme i našim pacientům. Nejistota vychází z toho, že nemáme s léčbou na této úrovni žádnou dlouhodobou klinickou zkušenost, takže se všichni od sebe vzájemně učíme. Naštěstí odborná komunita v rámci nervosvalových nemocí je relativně malá, takže spolupracujeme jak v rámci Evropy, tak i celosvětově.
Prvním pacientem byl tehdy ani ne dvouletý chlapec. Co předcházelo tomu, než mu mohl být genový lék podán?
Situace tehdy byla výjimečná a šlo o velmi hektické období, a to z více důvodů. Lék byl jako první registrován ve Spojených státech amerických, v Evropské unii v té době ještě registraci neměl. Jednalo se ale o tak převratnou léčbu, že pacienti o ni měli velký zájem a snažili se k ní dostat. Proto jsme potřebovali vypsat specifický léčebný program. Na to jsme ale měli asi jen dva měsíce, protože se vědělo, že bude registrace léčiva v EU, a pacienti se obávali, že by mohla mít jiná indikační kritéria než v USA. Tím by se mohlo teoreticky stát, že by na léčbu nedosáhli.
Do plánů vypsat specifický léčebný program přišla první vlna covidu, takže lidé se báli chodit do nemocnic, byly zde restrikce, veřejné úřady nepracovaly ve standardním módu. Přitom my jsme museli mít mimo jiné povolení od Státního ústavu pro kontrolu léčiv a ministerstva zdravotnictví a tím, že se jedná o genovou léčbu, také od ministerstva zemědělství, protože teoreticky se virus, který u léčby funguje jako nosič (vektor), může dostat do přírody. Do toho jsme se snažili sehnat všechny dostupné informace o léčbě včetně nežádoucích účinků a řešili smlouvy s pojišťovnami, aby bylo jasné, kdo bude garantovat léčbu nežádoucích účinků.
Problémem byla také cena genetického léku, protože tím, že je opravdu první ve svém typu léčby a jde o jednorázové podání, tak je, bohužel, i nejdražším lékem v medicíně vůbec. (Léčivo má v ČR určenou maximální cenu ve výši 51,7 milionů Kč, pozn. red.) Takže byla i otázka, kdo lék uhradí. Zpočátku proto iniciativy rodičů vypisovaly sbírky, pak ale přišlo politické rozhodnutí, že léčba bude hrazena z veřejného zdravotního pojištění, takže pacienti za léčbu nemuseli platit, i když ji měli v rámci specifického léčebného programu.
Nakonec se specifický léčebný program otevřít podařilo. Bohužel jsme ale do něj nevzali všechny pacienty, protože genovou léčbu jsme tu chvíli vyhodnotili pro jednoho z nich jako rizikovou.
Genovou terapii používáte pro velmi malé pacienty s těžkými formami SMA. Jaký je její princip?
Ztrátu části genu nahradíme umělým syntetickým lidským genem. Takže to, že se narodí pacient, který nemá část genu, se vyřeší náhradou vyrobenou v laboratoři.
Pro přenos umělého genu do buněk pacienta se využívají přenašeče, kterým se říká vektory. Vektor zajistí, aby se léčba dostala ke správným buňkám a nezničil ji ještě před tím imunitní systém. Co je vektorem v případě genové terapie u SMA?
Používá se při ní rekombinační adenoasociovaný virus typ 9. Jako možný vektor byl vybrán, protože nezpůsobuje žádné lidské onemocnění a dobře proniká do nervových buněk. Virový vektor se není schopen v těle pacienta množit, protože mu chybí jeho genetická informace. Ta se z něj v laboratoři vyjme a nahradí se lidskou, umělou DNA, která chybí pacientovi.
Adenovirus typ 9 získává výrobce léčiva ze zvířat?
Ne, vyrobí jej uměle. Je to synteticky vyrobený adenoasociovaný virus označovaný jako AAV9.
Modifikovaný, ale zvířecí adenovirus obsahuje také vakcína proti covidu od společnosti AstraZeneca. Zřejmě i proto se v době vrcholící očkovací kampaně objevily dezinformace o genové terapii uplatňované na lidstvu prostřednictvím vakcín.
Očkování proti covidu s tím, jak probíhá léčba SMA, nemá nic společného. Obě věci spolu nijak nesouvisí a jsou naprosto nesrovnatelné. Navíc my neměníme DNA pacienta. Pouze mu dodáme umělou DNA, která mu chybí, a tím řešíme poruchu v jeho organismu.
Takže když se někdy o genové terapii hovoří či píše jako o „přeprogramování organismu“, tak to nesedí?
Nesedí. Jde o náhradu chybění genu – doplníme pacientovi jen to, co mu chybí. Nic víc se nestane. Genetická informace vložená do vektoru se nezabuduje do DNA pacienta, ale v jádře buňky si utvoří vlastní oblast, takzvaný epizom, a tam tvoří informaci (mRNA) pro tvorbu chybějící bílkoviny.
Jak se uměle vytvořená lidská DNA dostane tam, kam má?
Umělá DNA vložená do vektoru se infuzí do periferní krve přenese do všech buněk v těle pacienta, dobře proniká zejména do nervových buněk. V jejich jádře se usídlí a teoreticky celoživotně tvoří chybějící bílkovinu.
Čím je dáno, že bílkovina se má dle výrobce po podání léku tvořit doživotně?
To je dáno tím, že nervové buňky se nedělí, takže v nich daná syntetická DNA zůstává. Ona se sice dostane do většiny buněk organismu, ale ty se na rozdíl od nervových buněk během života dělí, tedy množí. Jenže při dělení se syntetická DNA do nových buněk již nedostává.
Jaká kritéria musí splňovat děti, aby jim mohla být terapie podána?
Jsou vesměs shodná jako před dvěma lety. Podstatná je váha pacienta. Ta v ČR nesmí být vyšší než 13,5 kg. Druhým kritériem pro léčbu je věk pacienta. Léčba je prozatím vhodná pro děti do věku téměř tří let. Důležité také je, aby pacient neměl protilátky proti viru, který se při léčbě používá jako vektor. Tedy že se s virem ještě ve svém životě nepotkal. Zjistíme to vyšetřením, které se jako jediné před podáním genové terapie dělá mimo naši nemocnici. Prozatím je zvládne jen jedna laboratoř v Evropě, v Rotterdamu, kam posíláme vzorky. Pacient také musí projít interními vyšetřeními. Odebereme četné vzorky krve, moči, provedeme ultrazvuky břicha, srdce, doplníme EKG, vyšetříme mu plicní funkce. Tím zjistíme, zda netrpí nějakou chronickou infekcí, a vyhodnotíme, zda není vyšší riziko nežádoucích účinků, které by mohlo převýšit možný benefit léčby.
Jak vypadá samotná aplikace genového léčiva?
Není vůbec nijak složitá. V podstatě se jedná o hodinovou infuzi do periferní krve.
Tedy kanylou do ruky dítěte?
Většinou to tak bývá. To znamená, že pacient je v postýlce a hodinu mu kape infuze.
Musí při tom být v anestezii?
Ne. Děti to vydrží a v postýlce si mohou v podstatě dělat cokoliv, jen při tom mají infuzi. Takže se mohou dívat na pohádky, povídat si s rodiči, hrát si.
Co se v těle odehrává při léčbě?
Tělo pacienta zaplavíme obrovským množstvím virových partikulí, které nesou zdravý gen, jenž pacientovi chybí. Množství virového vektoru je opravdu obrovské, je to 1,1 × 10¹⁴ genomu vektoru na 1 kg váhy pacienta, takže to je pro organismus obrovská nálož. Proto je také hlavním indikačním kritériem váha pacienta – čím je lehčí, tím je virového vektoru méně a je nižší riziko nežádoucích účinků. AAV9 virus sám o sobě nezpůsobuje žádná lidská onemocnění, přesto imunitně je to velký stimul a má rizika pro pacienta.
Je tedy po infuzi nutné, aby dítě zůstalo v nemocnici?
Celosvětově jsou režimy různé. My jsme ve shodě s Německem, že dítě po aplikaci zůstává minimálně 4 nebo 5 dnů v nemocnici. Pokud se objevují nežádoucí účinky, tak se hospitalizace protahuje. Pokud jsou veškeré výsledky vyšetření příznivé, tak může přejít do ambulantní péče, ale první 3 týdny potřebujeme, aby byl pacient v relativní blízkosti Motola. To znamená, pokud je pacient třeba z Ostravy, tak první 3 týdny či měsíc je ubytován v blízkosti nemocnice. Může být třeba v hotelu nebo tady na ubytovně. A dochází sem ambulantně.
Jak často k vám nyní jezdí malý pacient, který genovou terapii dostal jako první před necelými dvěma lety?
Jednou za tři měsíce.

„To, že se narodí pacient, který nemá část genu, se vyřeší náhradou vyrobenou v laboratoři,“ popisuje unikátní léčbu svalové atrofie Jana Haberlová
S jakými typy nežádoucích účinků jste se zatím setkali?
Nejčastěji pacienti mají mírné nežádoucí účinky, jakými je teplota a zvracení, protože adenoasociovaný virus se vylučuje zažívacím traktem, ale to není žádný zásadní problém. Zásadním problémem je reakce krevních buněk v 1. týdnu po podání, kdy dochází k jejich obrovskému rozpadu a imunitní reakci. Ta může způsobit v extrémních případech i selhání ledvin. Následně pak reakce jaterních buněk, kdy dochází k rozvoji imunitně podmíněné hepatopatie, tedy k zánětu jater. Zánět jater může mít různé fáze a teoreticky může vést k chronickému poškození jater. U tohoto typu léčby zatím nebyl popsán žádný případ, kdy došlo k selhání jater. Ale poškození jater jako takové je možné a je potřeba být opravdu obezřetný.
Zaznamenali jste něco takového ve FN Motol?
Vidíme příznaky poškození jater, řešíme je s našimi hepatology. Máme obrovskou výhodu, že v rámci FN Motol máme dostupné veškeré specializace dětských oborů v jedné budově. Díky této léčbě jsme navázali spolupráci s hepatology, hematology a hematoonkology. Je to týmová práce a já za ni svým kolegům velmi děkuji. Díky spolupráci jsme zatím neměli žádné život ohrožující nežádoucí účinky, přesto musíme být obezřetní. Obecně některé klinické studie systémové genové léčby – u jiných diagnóz využívající jiný virový vektor i jiné dávkování – jsou zastaveny pro výskyt selhání jater s následkem úmrtí.
Postižení jater, které jste po genové léčbě viděli, časem pacient zvládne, nebo bude mít trvalé následky?
Naši pacienti prozatím nemají žádné trvalé poškození jater. Měli pouze přechodné, které jsme řešili navýšením imunosupresivní léčby.
Tyto léky potlačují imunitu pacienta. Je podávání imunosupresiv po léčbě Zolgensmou celoživotní?
Většina našich pacientů se veškeré imunosuprese zbavila do 5. měsíce po podání.
Zaznamenali jste i závažnější účinky, které by se týkaly jiného orgánu než jater?
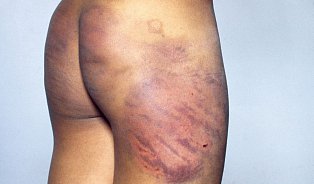
Často vidíme rozpad krevních buněk, snížení počtu krevních destiček, imunitní reakci během 1. či 2. týdne. Opět to byla přechodná záležitost bez zásadnějších konsekvencí. Například ve světě popsané případy renálního selhání ledvin jsme zatím nepozorovali.
Nedostatek krevních destiček se projevuje krvácením?
Teoreticky ano, ale my jsme nic takového u pacientů nemuseli řešit. Nicméně v jiných centrech bylo pozorováno, že pacienti měli drobné krvácení do tkání.
Bavíme se o tom, že genová léčba SMA je nová věc, která má svá rizika. Zaznamenali jste už případ, kdy ji rodina malého pacienta raději odmítla?
Ano, máme jednu rodinu, která raději zůstala na chronické medikaci, než by podstoupila genovou léčbu.
Jak se daří dětem, které genovou terapii dostaly?
Všechny dělají pokroky. To je něco, co by při přirozeném průběhu nemoci nikdy nenastalo. Pacienti by bez léčby své motorické schopnosti jen ztráceli, ale teď po léčbě se zlepšují. A náš první pacient, Max, už je schopen se sám posadit, u opory postavit, a dokonce ušel u opory i pár kroků, přičemž před léčbou nebyl schopen se sám ani posadit. Léčbu už jsme mohli podat i novorozenci, který se narodil na Halloween, tedy 31. října 2021, a ten se vyvíjí prozatím jako zcela zdravé dítě, za což jsme moc rádi.
Pokud by lék nedostal, tak už by se u něj nemoc projevila?
Určitě. Už by měl příznaky, ale díky léčbě vypadá jako zdravý kojenec. Ale je potřeba i říci, že našimi pacienty jsou děti, které jsou malé. To znamená, že i zdravé dítě se učí motorické dovednosti. Tím, jak je chytřejší, umí své tělo lépe koordinovat, takže je ve zlepšení i faktor přirozeného vývoje. Jejich motorický pokrok tedy nejde jen na vrub léčby.
Genová terapie dokáže SMA léčit, ale může tuto nemoc i vyléčit?
Od ledna letošního roku v ČR běží pilotní projekt novorozeneckého screeningu na SMA, takže nemoc může být zachycena dříve, než se rozvinou obtíže s ní spojené. Pokud se to podaří a vy léčbu podáte, tak data z klinických studií ukazují, že pacient by mohl mít klinicky zcela normální vývoj motoriky. V těchto případech jednorázovou infuzí vyřešíte genetickou poruchu novorozence a pacient odejde a už vás teoreticky nebude v budoucnu potřebovat. Samozřejmě po infuzi je třeba sledovat možné nežádoucí účinky. Nicméně to je to velké kouzlo, proč si pacienti, nebo spíše jejich rodiče, přejí genovou léčbu. Je jednorázová.
Opravdu může efekt vydržet po celý život pacienta?
To s jistotou nevíme. Zatím máme data z klinických studií téměř za sedm let a efekt léčby se zatím drží. Co ale bude za dalších deset let, dnes nikdo neví.
Obejít přírodu je někdy velmi složité…
Ano, ale já si myslím, že jsme na začátku cesty, která nám otevřela úplně nové možnosti. Budeme postupně zjišťovat podrobněji, jak genová léčba funguje nebo jaké jsou její nežádoucí účinky. A v budoucnu ji můžeme pozměnit. Určitě se bude vyvíjet struktura virových vektorů a transgenů, eventuálně i jiných typů vektorů.
Může se ukázat, že tato genová terapie je zcela slepou cestou?
To se stát může, je tu problém imunitní reakce organismu na virový vektor a nejistota udržení efektu. Může se stát, že se ukáže, že virus není ideálním nosičem a bude potřeba najít jinou formu vektoru. Přesto věřím, že princip náhrady chybějícího genu genem syntetickým není slepou cestou.
Vracíme se tedy k vašim dřívějším slovům, že dětská neurologie je jedním z nejvíce se vyvíjejících oborů medicíny. Dokážete si představit, kde bude tento obor za pět nebo deset let?
Doufám, že budeme schopni léčit vyšší počet diagnóz než dnes, kdy to jsou dvě nejčastější: SMA a Duchenneova svalová dystrofie. U nich už máme nějakou dostupnost léčby. Věřím ale, že v budoucnu budeme mít i u méně častých nemocí možnost zásadním způsobem změnit prognózu i zlepšit kvalitu života pacienta i jeho blízkých. Doufám, že každým rokem budou přibývat nové možnosti léčby, a budeme tak následovat obory jako třeba hematoonkologie, ve které je pokrok léčby za poslední dekády obrovský.

Doc. MUDr. Jana Haberlová, Ph.D.
Lékařka Kliniky dětské neurologie 2. LF UK a FN Motol. Ošetřující lékařka prvního pacienta, kterému v ČR byla podána systémová genová léčba SMA.
Ve FN Motol vede Centrum vysoce specializované péče pro vzácná neuromuskulární onemocnění dětí. Je členkou a odborným sekretářem Společnosti dětské neurologie ČLS JEP.